Термодинамическая энтропия S, часто просто именуемая энтропия, — физическая величина, используемая для описания термодинамической системы, одна из основных термодинамических величин. Энтропия является функцией состояния и широко используется в термодинамике, в том числе химической.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы приобратимом процессе как отношение общего количества тепла 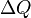 к величине абсолютной температуры
к величине абсолютной температуры  :
:
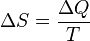 .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся выделением тепла, вследствие изменения структуры.
энтропия зависит от:
-
агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
-
изотопного состава (H2O и D2O).
-
молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
-
строения молекулы (н-C4H10, изо-C4H10).
-
кристаллической структуры (аллотропии) – алмаз, графит.

