Размер самой маленькой структуры, которую можно видеть с
помощью микроскопа, определяется наименьш им разрешаемым расстоянием
(d), которое в основном зависит от длины волны света (А.) и длины волн
электромагнитных колебаний потока электронов и др. Эта зависимость
приближенно определяется формулой d = дл. волны/2.
Световая микроскопия - источником освещения служит естественный или искусственный свет
(рис. 2.1). Минимальная длина волны видимой части спектра примерно 0,4 мкм.
Следовательно, для обычного светового микроскопа наименьшее разрешаемое
расстояние приблизительно составляет 0,2 мкм, а общее увеличение (произведение увеличения объектива на увеличение окуляра) может быть 1500—2500.
Можно увидеть не только отдельные клетки размером от 4 до 150 мкм, но и их внутриклеточные структуры — органеллы, включения. Д ля усиления контрастности
микрообъектов применяю т их окрашивание.
Ультрафиолетовая микроскопия. Это разновидность световой м икроскопии - использую т более короткие ультрафиолетовые лучи с длиной волны около 0,2 мкм. Разрешаемое расстояние здесь в 2 раза меньше - приблизительно 0,1 мкм. Полученное в ультрафиолетовых лучах невидимое
глазом изображение преобразуется в видимое с помощью регистрации на
фотопластинке или путем прим енения специальны х устройств (люминесцентный
экран, электронно-оптический преобразователь).
Флюоресцентная (люминесцентная) микроскопия - атомы и молекулы ряда веществ, поглощая коротковолновые лучи, переходят в возбужденное состояние. Обратный переход из возбужденного состояния в нормальное происходит с испусканием света, но с большей длиной волны.
В флюоресцентном микроскопе в качестве источников
света для возбуждения флюоресценции применяют ртутные или ксе-
ноновые лампы сверхвысокого давления, обладающие высокой яркостью в
области спектра 0,25—0,4 мкм (ближние ультрафиолетовые лучи) и 0,4—0,5 мкм
(сине-фиолетовые лучи). Длина световой волны флюоресценции всегда больше
длины волны возбуждающего света, поэтому их разделяют с помощью светофильтров и изучают изображение объекта только в свете флюоресценции.
Любая клетка живого организма обладает собственной флюоресценцией,
однако она часто бывает чрезвычайно слабой.
Различают собственную, или первичную, и наведенную, или вторичную, флю оресценцию.
Первичной флюоресценцией обладают серотонин, катехоламины (адреналин,
норадреналин), содержащиеся в нервных, тучных и других клетках, после
фиксации ткани в парах формальдегида при 60—80 °С (метод Фалька).
Вторичная флюоресценция возникает при обработке препаратов специальными
красителям и — флюорохромами.
Существуют различные флюорохромы, которые специфически связываются
с определенными макромолекулами (акридиновый оранжевый, родамин,
флюоресцеин и др.). Например, при обработке препаратов акридиновым
оранжевым ДН К и ее соединения в клетках имеют ярко-зеленое, а РНК и ее
производные — ярко-красное свечение. Существует много красителей, с помощью
которых можно выявить белки, липиды, внутриклеточные ионы кальция,
магния, натрия и др. Таким образом, спектральный состав излучения
несет информацию о внутреннем строении объекта и его химическом составе.
/imgs/2019/08/05/10/3490192/ec2b106329e74af05d8fddb8ee42e836d982f3ba.jpg)
Вариант метода флюоресцентной микроскопии, при котором и возбуждение,
и излучение флюоресценции происходят в ультрафиолетовой области спектра,
получил название метода ультрафиолетовой флюоресцентной микроскопии.
Для повыш ения контрастности флюорохромированных объектов применяется
конфокальный вариант оптического микроскопа (см. рис. 2.1, в).
В качестве освещ ения используется пучок монохроматического света малого
диаметра, который создает лазерный источник. В каждый момент времени
в фокусе микроскопа находится небольш ой участок (объем) клетки.
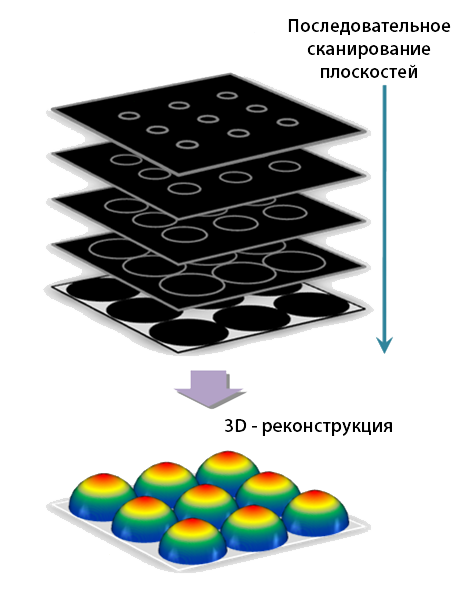
Пучок света перемещается по объекту (сканирует объект по осям X, Y, Z).
При каждом перемещ ении пучка света по одной из ли н и й скан ирован и я
получается инф орм ация об исследуемой структуре, находящ ейся в данной
точке (объеме) по ли н и и сканирования (оптическом срезе клетки), н ап ри мер
о локализации белков в составе микротрубочек в клетке. Вся полученная
инф орм ация от каждой точки скан ирован и я клетки передается на
компьютер, объединяется с помощью специальной программы и выдается
на экран монитора в виде контрастного изображ ения. С помощью данного
метода микроскопии получается инф орм ация о форме клеток, цитоскелете,
структуре ядра, хромосом и др. С помощью программы компью тер на
основе полученной инф орм ации по каж дой ли н и и скан ирован и я создает
объемное изображение клетки, что позволяет рассматривать клетку под
разными углами зрения.
Фазово-контрастная микроскопия - этот метод служит для получения контрастных изображений прозрачных и бесцветных живых объектов, невидимых при обычных методах микроскопирования.
Метод основан на том, что свет,
проходя структуры с различным коэффициентом преломления, изменяет свою
скорость. Используемая конструкция оптики микроскопа дает возможность
преобразовать не воспринимаемые глазом фазовые изменения прошедшего
через неокрашенный препарат света в изменения его амплитуды, т. е. яркости
получаемого изображения. Метод фазового контраста обеспечивает контрастность
изучаемых неокрашенных структур за счет специальной кольцевой диафрагмы,
помещаемой в конденсоре, и так называемой фазовой пластинки,
находящейся в объективе. Разновидностью метода фазового контраста является
метод фазово-темнопольного контраста, дающий негативное по сравнению
с позитивным фазовым контрастом изображение.

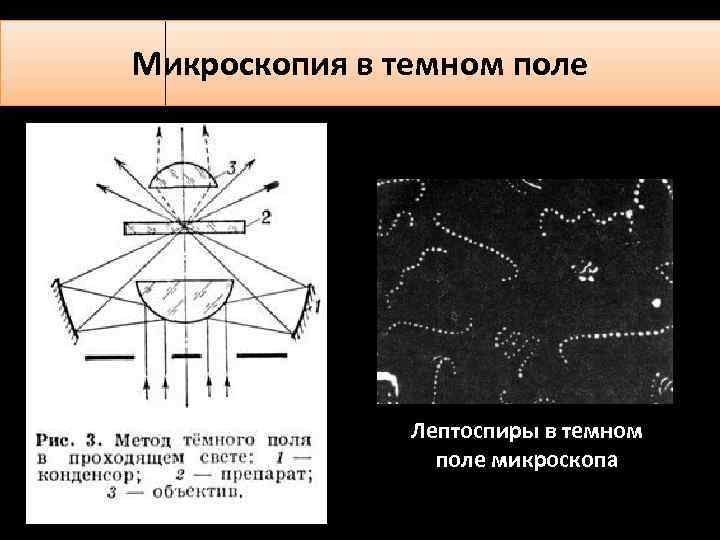
Микроскопия в темном поле. В темнопольном микроскопе только свет,
который дает диф ракцию (огибание волнами) структур в препарате, достигает
объектива. Происходит это благодаря наличию в микроскопе специального
конденсора, который освещ ает препарат строго косым светом; лучи
от осветителя направляю тся сбоку. Таким образом, поле вы глядит темны м,
а мелкие частицы в препарате отраж аю т свет, которы й далее попадает в
объектив. В клинике этот метод прим еняю т для изучения кристаллов в
моче (мочевая кислота, оксалаты), для демонстрации спирохет, в частности
Treponema pallidum, вызывающей сифилис, и др.
Интерференционная микроскопия. Разновидностями ф азово-контрастного
микроскопа являю тся интерф еренционны й м икроскоп, который предназначен
для количественного определения массы ткани. Диференциальный
интерференционный микроскоп (с оптикой Номарского) использую т для
изучения рельефа поверхности клеток и других биологических объектов.
В интерференционном микроскопе пучок света от осветителя разделяется
на два потока: один проходит через объект и изменяется по фазе колебания,
второй идет, минуя объект. В призмах объектива оба пучка н аклады ваются
друг на друга. В результате строится изображение, в котором участки
микрообъекта разной толщ ины и плотности различаю тся по степени контрастности.
Проведя количественную оценку изменений, определяю т концентрацию
и массу сухого вещества.
Ф азово-контрастны й и и нтерф ерен ц и онн ы й м икроскопы позволяю т
изучать живые клетки. В них используется интерф еренция, возникаю щ ая
при комбинации двух наборов волн и создаю щ ая изображение микроструктур.
Преимущ еством ф азово-контрастной, интерф еренционной и тем нопольной
микроскопии является возможность наблюдать клетки в процессе
движения и митоза. При этом регистрация движ ения клеток может производиться
с помощью цейтраферной (покадровой) микровидеосъемки.


