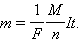Устройства, вырабатывающие электрический ток за счет энергии окислительно-восстановительной реакции, называются химическими источниками тока.
Простейшим примером химического источника тока может служить медно-цинковый гальванический элемент Даниэля-Якоби. В других широко применяемых гальванических элементах используются не два электролита, как в медно-цинковом, а один, что удобнее в эксплуатации. Эти элементы относятся к первичным источникам тока, так как они предназначены для одноразового использования (или в несколько приемов).
Вторичные химические источники тока допускают многократное их использование - аккумуляторы. Они характеризуются обратимостью: после разрядки их работоспособность может быть восстановлена пропусканием тока от внешнего источника в обратном направлении (электролиз).
Аккумуляторы - приборы, которые служат для накопления химической энергии, превращающейся по мере необходимости в электрическую.
Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
|
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
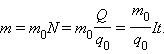 |
Здесь m0 и q0 – масса и заряд одного иона, 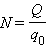 – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
– число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
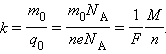 |
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA – постоянная Фарадея.
| F = eNA = 96485 Кл / моль. |
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
|