Частицы любого тела — атомы или молекулы — совершают хаотическое непрекращающееся движение (так называемое тепловое движение). Поэтому каждая частица обладает некоторой кинетической энергией. Кроме того, частицы вещества взаимодействуют друг с другом силами электрического при- тяжения и отталкивания, а также посредством ядерных сил. Стало быть, вся система частиц данного тела обладает ещё и потенциальной энергией. Кинетическая энергия теплового движения частиц и потенциальная энергия их взаимодей- ствия вместе образуют новый вид энергии, не сводящийся к механической энергии тела (т. е. кинетической энергии движения тела как целого и потенциальной энергии его взаимодействия с другими телами). Этот вид энергии называется внутренней энергией.
Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц плюс потенциальная энергия их взаимодействия друг с другом. Внутренняя энергия термодинамической системы — это сумма внутренних энергий тел, входящих в систему. Таким образом, внутреннюю энергию тела образуют следующие слагаемые.
1. Кинетическая энергия непрерывного хаотического движения частиц тела.
2. Потенциальная энергия молекул (атомов), обусловленная силами межмолекулярного вза- имодействия.
3. Энергия электронов в атомах.
4. Внутриядерная энергия.
В случае простейшей модели вещества — идеального газа — для внутренней энергии можно получить явную формулу. Внутренняя энергия одноатомного идеального газа Потенциальная энергия взаимодействия частиц идеального газа равна нулю (напомним, что в модели идеального газа мы пренебрегаем взаимодействием частиц на расстоянии). Поэтому внутренняя энергия одноатомного идеального газа сводится к суммарной кинетической энергии поступательного1 движения его атомов. Эту энергию можно найти, умножив число атомов газа N на среднюю кинетическую энергию E одного атома:
U = NE = N · 3/2 kT = νNA · 3 /2 kT = 3/ 2 νRT, или U = 3 /2 m µ RT.
Мы видим, что внутренняя энергия идеального газа (масса и химический состав которо- го неизменнны) является функцией только его температуры. У реального газа, жидкости или твёрдого тела внутренняя энергия будет зависеть ещё и от объёма — ведь при изменении объ- ёма изменяется взаимное расположение частиц и, как следствие, потенциальная энергия их взаимодействия. .
1Функция состояния Важнейшее свойство внутренней энергии заключается в том, что она является функцией со- стояния термодинамической системы. А именно, внутренняя энергия однозначно определяется набором макроскопических параметров, характеризующих систему, и не зависит от «предысто- рии» системы, т. е. от того, в каком состоянии система находилась прежде и каким конкретно образом она оказалась в данном состоянии. Так, при переходе системы из одного состояния в другое изменение её внутренней энергии определяется лишь начальным и конечным состояниями системы и не зависит от пути пере- хода из начального состояния в конечное. Если система возвращается в исходное состояние, то изменение её внутренней энергии равно нулю. Опыт показывает, что существует лишь два способа изменения внутренней энергии тела:
• совершение механической работы;
• теплопередача
| Содержание | Величина | Наименование |
 Q - энергия, которую тело теряет или приобретает при передаче тепла. Q - энергия, которую тело теряет или приобретает при передаче тепла.Формула количества теплоты зависит от протекающего процесса. Формулы количества теплоты при некоторых процессах: 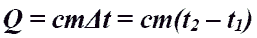 Количество теплоты при нагревании и охлаждении. Количество теплоты при нагревании и охлаждении.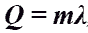 Количество теплоты при плавлении или кристаллизации. Количество теплоты при плавлении или кристаллизации.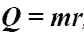 Количество теплоты при кипении, испарении жидкости и конденсации пара. Количество теплоты при кипении, испарении жидкости и конденсации пара.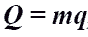 Количество теплоты при сгорании топлива. Количество теплоты при сгорании топлива.Количество теплоты всегда передается от более горячих тел к более холодным до достижения ими одинаковой температуры (теплового равновесия), если нет иных процессов, кроме теплопередачи. В замкнутой системе тел выполняется уравнение теплового балланса: Q1 + Q2 + ... = 0 - количество теплоты, которое теряют горячие тела, равно количеству тепла, получаемому холодными. Полезные формулы: 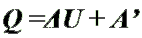 Количество теплоты, переданное телу, Количество теплоты, переданное телу, идет на изменение его внутренней энергии и на совершение им работы (Первый закон термодинамики). Закон Джоуля-Ленца: в неподвижном металлическом проводнике вся энергия электрического тока превращается в тепло: 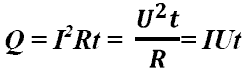 - закон Джоуля - Ленца. - закон Джоуля - Ленца. |
Постоянное эквивалентное отношение между теплотой и работой при их взаимных переходах установлено в классических опытах Д.П.Джоуля (1842-1867). Типичный эксперимент Джоуля заключается в следующем.
Падающий с известной высоты груз вращает мешалку, погруженную в воду, находящуюся в калориметре (груз и калориметр с водой составляют термодинамическую систему.) Вращение лопастей мешалки в воде вызывает нагревание воды; соответствующее повышение температуры количественно фиксируется.
После того, как указанный процесс закончен, система должна быть приведена в исходное состояние. Это можно сделать путем мысленного опыта. Груз поднимается на исходную высоту, при этом затрачивается извне работа, которая увеличивает энергию системы. Кроме того, от калориметра отнимается (передается в окружающую среду) теплота путем охлаждения его до исходной температуры. Эти операции возвращают систему к исходному состоянию, т. е. все измеримые свойства системы приобретают те же значения, которые они имели в исходном состоянии. Процесс, в течение которого свойства системы изменялись, и в конце которого она вернулась к исходному состоянию, называется круговым (циклическим) процессом или циклом.
Единственным результатом описанного цикла является отнятие работы от среды, окружающей систему, и переход в эту среду теплоты, взятой у калориметра.
Сравнение этих двух величин, измеренных в соответствующих единицах, показывает постоянное отношение между ними, не зависящее от величины груза, размеров калориметра и конкретных количеств теплоты и работы в разных опытах.
Теплоту и работу в циклическом процессе целесообразно записать как сумму (интеграл) бесконечно малых (элементарных) теплот dQ и бесконечно малых (элементарных) работ dW, причем начальный и конечный пределы интегрирования совпадают (цикл).
Условимся считать положительными теплоту, полученную системой от окружающей среды, и работу, произведённую системой (энергия в форме работы передается при этом от системы к окружающей среде).
Тогда эквивалентность теплоты и работы в циклическом процессе можно записать так:
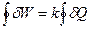 (I, 1)
(I, 1)

