Вопрос 1 Ферменты, коферменты и витамины.
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически(Соединяясь с белковой частью молекулы фермента — апоферментом, коферменты образуют каталитически активный комплекс — холофермент. Прочно связанные с белками коферменты называются простетическими группами.) соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента.
Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента, называемую холоферментом
Роль коферментов нередко играют витамины или их метаболиты (чаще всего — фосфорилированные формы витаминов группы B). Например, коферментом ферментакарбоксилазы является тиаминпирофосфат, коферментом многих аминотрансфераз — пиридоксаль-6-фосфат.
В металлоферментах роль, аналогичную роли коферментов, могут исполнять катионы металлов, однако коферментами их обычно не называют.
Ферменты – это вещества, без которых невозможно течение множества процессов в организме. На самом деле, ферменты принимают участие не только в переваривании пищи, но и в работе центральной нервной системы, в процессах роста новых клеток. Ферменты относятся к белкам. Но в их составе есть и минеральные соли. Ферментов достаточно много и каждый обладает совершенно уникальным действием на узкий круг веществ. Ферменты не могут заменять друг друга. Ферменты могут действовать только при температуре, не превышающей пятидесяти четырех градусов. Но и слишком низкие температуры тоже не способствуют их активности. Ведь «работают» ферменты в человеческом теле и оптимальна для них именно температура тела. Губителен для ферментов солнечный свет и кислород. Метаболизм жиров, белков, минералов и углеводов проходит только в присутствии ферментов. Ферменты действуют в кишечнике. При этом витамин Е помогает ферментам достичь в неизменном состоянии кишечника. Работа ферментов значительно сокращает энергетические затраты организма на переработку пищи. Если Вы не любитель сырых фруктов и овощей, то, скорее всего, у Вас в организме ферментов вырабатывается недостаточно. Все ферменты разделяются на три основных группы: амилаза, липаза и протеаза. Фермент амилаза необходим для переработки углеводов. Под воздействием амилазы углеводы разрушаются и легко всасываются в кровь. Амилаза присутствует как в слюне, так и в кишечнике. Амилаза тоже бывает разной. Для каждого вида сахаров существует собственный вид этого фермента. Липаза – это ферменты, которые присутствуют в желудочном соке и вырабатываются поджелудочной железой. Липаза необходима для усвоения организмом жиров. Протеаза – это группа ферментов, которые присутствуют в желудочном соке и тоже вырабатываются поджелудочной железой. Кроме этого, протеаза присутствует и в кишечнике. Протеаза необходима для расщепления белков. Существуют такие ферменты, которые запускают процессы обмена веществ внутри клеток. Практически нет в организме такой системы, которая не вырабатывала бы свои ферменты. Существуют и продукты питания, в которых есть собственные ферменты. Это авокадо, ананасы, папайя, манго, бананы и различные пророщенные зерна. В организме вырабатываются и так называемые протеолитические ферменты, которые не только участвуют в пищеварении, но еще и снимают воспалительные процессы. К таким ферментам относят панкреатин, пепсин, ренин, трипсин и химотрипсин. Наиболее распространенным в лекарственной форме является фермент панкреатин. Его применяют в случае нехватки ферментов в организме, для облегчения переваривания пищи, при аллергиях на еду, различных тяжелых нарушениях иммунитета, а также других сложных внутренних болезнях. Если Вы страдаете ферментной недостаточностью, то предпочтительнее использовать такие лекарства, которые содержат сразу несколько ферментов. Но есть препараты, содержащие только один какой-либо фермент. Обычно ферментные препараты нужно употреблять во время еды, но иногда эффективнее прием после еды. Лекарственные средства, которые содержат ферменты, следует держать в холодильнике. Ферментные препараты смело можно назвать БАД (биологически активными добавками). Но применять их бесконтрольно на протяжении длительного времени все же не стоит. Лучше проконсультироваться с врачом.
Витами́ны (от лат. vita — «жизнь») — группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической природы. Это сборная по химической природе группа органических веществ, объединённая по признаку абсолютной необходимости их для гетеротрофного организма в качестве составной части пищи. Автотрофные организмы также нуждаются в витаминах, получая их либо путём синтеза, либо из окружающей среды. Так, витамины входят в состав питательных сред для выращивания организмов фитопланктона[1]. Большинство витаминов являются коферментами или их предшественниками[2].
Витамины содержатся в пище (или в окружающей среде) в очень малых количествах, и поэтому относятся к микронутриентам. К витаминам не относят микроэлементыи незаменимые аминокислоты[2].
Наука на стыке биохимии, гигиены питания, фармакологии и некоторых других медико-биологических наук, изучающая структуру и механизмы действия витаминов, а также их применение в лечебных и профилактических целях, называется витаминологией
Витамин А. Известны два соединения с активностью витамина А: ретинол (витамин А1) ретиналь (витамин А2). В тканях ретинол превращается в сложные эфиры: ретинилпальмитат, ретинилацетат и ретинилфосфат. Витамин А и его производные находятся в организме в транс конфигурации, лишь в сетчатке глаза образуются цис-изомеры ретинола и ретиналя.
Каротиноиды. Каротиноиды встречаются практически во всех животных и растениях, особенно в организмах, развивающихся на свету. Описано около 563 вида каротиноидов (Штрауб О., 1987), не считая их цис- и транс-изомеров. Основными каротиноидами и полиенами являются:
- альфа- и бета-каротины и бета-ano-8-каротиноиды,
- бета-криптоксантин, астаксантин, кантаксантин, цитроксантин, неоксантин, виолаксантин, зеаксантин,
- лютеин,
- ликопин,
- фитоен, фитофлуен
Большинство каротиноидов является ксантофиллами, селективно поглощают свет, имеют обычно желтый цвет и придают желтую окраску осенним листьям. К основным ксантофиллам относятся лютеин и зеаксантин. Кроме ксантофиллов, существует группа каротинов (альфа-, бета- и гамма-каротины), к которым принадлежит наиболее известный каротиноид - бета-каротин, наиболее активный из всех каротиноидов. При расщеплении молекулы бета-каротина может образовываться 2 молекулы ретиналя, альфа- гамма- формы образуют лишь по одной молекуле витамина А. Однако в процессе метаболизма превращение бета- каротина в ретинол происходит и соотношении 6:1, т.е. из 6 мг бета-каротина образуется 1 мг ретинола. Для всех каротиноидов это соотношение составляет 12:1 .
Витамин D. Из многочисленных соединений, обладающих активностью витамина D (кальциферолы), наиболее важны для человека эргокальциферол (витамин D2) и холекальциферол (витамин D3). Основной предшественник витамина D - провитамин 7-дегидрохолестерин содержится в пище животного происхождения, а также образуется в слизистой оболочке тонкой кишки и в печени. В коже под воздействием определенного спектра естественного ультрафиолетового облучения он превращается в холекальциферол (витамин D3). Следует подчеркнуть, что при искусственном загаре витамин D в коже не образуется. В пище растительного происхождения содержится провитамин эргостерин, который в коже может превратиться в эргокальциферол (витамин D2). В организме человека активность обоих групп витаминов приблизительно одинакова. Эрго- и холекальциферолы, транспортируются в печень, где из них образуется 25-гидроксикальциферал, который в дальнейшем в почках гидроксилируется до 1,25-дигидроксикальциферола. Эта активная форма витамина D, поступая в кишечник, вызывает образование специфического кальций (Са)-связывающего белка, который усиливает всасывание Са в тонкой кишке. Одновременно этот метаболит ускоряет реабсорбцию Са в почечных канальцах.
Таким образом, недостаточность витамина D может наблюдаться не только при его дефиците в составе питания, но и при недостаточном образовании в коже при отсутствии солнечного облучения, а также и при заболеваниях печени и почек.
Витамин Е. Это группа из восьми химически родственных соединений - четырех токоферолов (альфа-, бета- гамма- и дельта-) и четырех токотриенолов, активность которых в качестве витамина Е сильно различается. Наиболее активной формой витамина является D-альфа-токоферол, однако дельта-токоферол обладает более высокой антирадикальной активностью.
Витамин К. Широко распространен в природе и представлен в двух формах. В зеленых растениях и водорослях содержатся витамины ряда K1 (филлохиноны). Продукты животного происхождения и бактерии содержат витамины ряда К2 (менахиноны).
Витамин В2. Рибофлавин (лактофлавин) в организме человека представлен в двух формах: флавинмононуклеотида и флавинадениндинуклеатида.
Витамин PP. Ниацин (никотиновая кислота) - два соединения, включающих никотиновую (пиридин-5-карбоновую) кислоту и никотинамид, имеющие одинаковую активность. Коферментные формы - НАД и НАДФ функционируют в составе более чем 100 дегидрогеназ.
Витамин В6. Объединяет пиридоксин, пиридоксамин и пиридоксаль,а также их фосфаты. Витамин поступает с пищей в форме пиридоксина, который фосфорилируется в тонкой кишке и в печени, а затем окисляется до пиридоксальфосфата. В качестве коферментов работают пидоксаль-5-фосфат и пиридоксаминфосфат.
Витамин В9. Фолиевая кислота (фолацин, птероилглутаминовая кислота) - группа родственных соединений, обладающих сходной биологической активностью, представлены фолиевой кислотой, ее многочисленными коферментными формами, а также ди- и полиглутаматами. При всасывании в кишечнике образуется тетрагидрофолиевая кислота и продукт ее метилирования.
Витамин В12. Кобаламин (цианкобаламин) - общее название группы соединений, которые характеризуются наличием атома кобальта в центре порфиринового кольца. В организме активностью витамина В12 обладают 6 форм кобаламина: цианкобаламин, гидроксикобаламин, кобаламин R, кобаламин S, метилкобаламин и аденозилкобаламин. Кобаламин образует две коферментные формы: метилкобаламин и дезоксиаденозилкобаламин.
С точки зрения физиологического действия все витамины можно разделить на три основных группы: витамины, обладающие свойствами коферментов, витамины, обладающие способностью к антиоксидантной (антирадикальной) активности и витамины, проявляющие гормоноподобное действие.
Вопрос 2 Биохимия как наука. Предмет и задачи биохимии.
Таким образом, биохимия состоит как бы из трех частей:
1) статическая биохимия (это анализ химического состава живых организмов);
2) динамическая биохимия (изучает совокупность превращения веществ и энергии в организме);
3) функциональная биохимия (исследует процессы, лежащие в основе различных проявлений жизнедеятельности).
Все указанные разделы неразрывно связаны друг с другом и являются частями одной и той же науки – современной биохимии.
Возникнув на стыке смежных дисциплин, таких как органическая и физическая химия, биохимия в то же время не стала каким-то механическим объединением этих дисциплин, несмотря на их некоторую общность. Перед биохимией и смежными с ней науками стоят совершенно различные задачи.
Главным для биохимии является выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях.
Современная биохимия решает следующие задачи:
1. Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок.
2. Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков.
3. Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками.
4. Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач.
Биохимия – это сравнительно молодая наука, она возникла на рубеже 19 в. Впервые в научной литературе термин «биохимия» использовал в 1903 году немецкий химик Карл Нойберг.
Как наука биохимия сформировалась относительно недавно, однако корни ее уходят в глубокую древность. Так на основе биохимических процессов развивались такие производства как сыроварение, хлебопечение, виноделие, выделка кожи и т.д.
Необходимость борьбы с болезнями заставляла задумываться о преврщении веществ в организме, искать объяснение целебным свойствам растений.
Авиценна (980-1037) – разработал первую химическую классификацию веществ, применяемых в медицине, и изложил ее в труде «Канон врачебной науки».
Средние века, период «алхимии» – это попытки создания химическим путем «панацеи» от всех болезней.
16-17 вв. – появилось особое направление «ятрохимия» от греч. «ятрос» – врач). Немецкий врач-ятрохимик Парацельс выдвинул прогрессивное по тем временам предположение о тесной связи химии и медицины.
Ван-Гель-Монт высказался о наличии в живых организмах факторов, участвующих в различных химических процессах.
17-18 вв. – немецкий химик и врач Шталь сформулировал теорию горючего начала – теорию «флогистона»: якобы в процессе горения из горючего вещества выделяется особое невесомое вещество – флогистон. Эти метафизические воззрения были опровергнуты работамиЛомоносова и Лавуазье, которые открыли законы сохранения массы. Лавуазье показал, что при горении, также как и при дыхании поглощается О2 и выделяется СО2.
К концу 18 в. был накоплен большой практический материал и выделено огромное количество органических соединений растительного и животного происхождения. Работы Реомюра и Спалланцони положили начало изучению ферментов пищеварительных соков.
1814 г. – русский ученый Кирхгофф описал осахаривание крахмала под действием фермента амилазы. Либих (1839) выяснил, что главные компоненты животных и растений – это белки, жиры, углеводы.
Бертло (1854) – провел синтез жиров; Бутлеров (1861) – синтез углеводов.
Накопление большого числа сведений о химическом составе животных и растений, химических превращениях, которые в них происходят, привело к систематизации уже имеющихся данных в учебных руководствах Либиха – в Европе, Ходнева – в России. Повсеместно в медицинских институтах открывались соответствующие кафедры.
Таким образом, в конце 19 в., появилась новая отрасль химии – биологическая химия, т.е. химия жизни, химия жизненных процессов. При этом: были заложены главные направления биохимии; открыты основные классы соединений, содержащиеся в живых организмах; были выделены белки из многих животных и растительных организмов; изучение продуктов гидролиза белков привело к открытию аминокислот (АК).
Открытие швейцарским ученым Мишером в 1869 г. ДНК привело к изучению нуклеиновых кислот (НК). Были поставлены первые опыты по взаимопревращению жиров, белков, углеводов. Возникло учение о витаминах (Лунин, Эйкман, Функ и другие), о ферментах (Манасеина, Павлов), гормонах (Бернар).
В 20 в. биохимия достигла подлинного расцвета: Фишером была обоснована пептидная теория строения белков; Кноопом, Ленинджером – окисление и биосинтез жирных кислот; Кребсом, Мейергофом – созданы схемы биохимических превращений углеводов и образования АТФ. К середине 20-го столетия были заложены серьезные основы к развитию таких направлений как биоэнергетика, генная инженерия, молекулярная биология и др. Достижения биохимии широко применяются в медицине, фармации, народном хозяйстве.
Белки – это высокомолекулярные азотсодержащие органические соединения, построенные из остатков α-аминокислот (АК).
Белки также называют протеинами (греч. protos – первый, важнейший). Белкам принадлежит решающая роль во всех процессах жизнедеятельности, они не встречаются в неживой природе.
Живая природа обладает рядом свойств, отличающих ее от неживой природы: это
1) способность живых организмов к воспроизводству себе подобных;
2) сократимость, движение;
3) высокий уровень структурной организации;
4) способность к эффективному преобразованию и использованию энергии;
5) обмен с окружающей средой и саморегуляция химических превращений.
Все эти свойства живой природы в большей мере обусловлены наличием в ней белков. Таким образом, белки составляют основу и структуры, и функций живых организмов.
1. Высокая вязкость белковых растворов.
2. Водные растворы белков имеют ясно выраженный коллоидный характер. Стабилизация коллоидных растворов белков обеспечивается зарядом частиц коллоидного раствора.
3. Способность белковых растворов к набуханию в больших пределах.
4. Растворы белков оптически активны, подвижны в электрическом поле, поглощают УФ-лучи при 280 нм.
5. Благодаря наличию свободных СООН– и NH2– групп проявляют амфотерные свойства. Кроме того, белки имеют высокую Mr, обладают изоэлектрической и изоионной точкой, денатурируют и ренатурируют и т.д.
В белках содержится до 55% – С; 20-25% – О; 16% – N, а также S, P, Mg и др. Доля азота в отличие от других элементов примерно одинакова и составляет 16% и содержание белка в материале часто определяют по количеству азота (сжигание по Къельдалю). Исключение составляет белки-протамины, которые содержат ~30% N.
Mr – относительная молекулярная масса белков. Она очень велика: от ≈6000Да до нескольких миллионов Да.
Например, Mr инсулина = 5733 Да, а вируса табачной мозаики – 40 млн.Да
Их можно определить путем кислотного гидролиза белков. Мономерами белков являются α-АК L-ряда. Соединение АК в полипептидную цепь (ППЦ) происходит посредством ковалентных пептидных связей –CO–NH–.
Некоторые природные, а также искусственно полученные полипептиды могут иметь большую Mr, но отнести их к белкам нельзя. Отличает их от белков уникальный признак, присущий только белкам – денатурация. При действии определенных веществ, так называемыхдетергентов, происходит потеря белком физико-химических свойств, а главное – биологической активности, при этом пептидные связи не разрываются. Таким образом, белки обладают сложной пространственной организацией.
Таковы характерные признаки белков.
В природе белки встречаются как в виде нитей – фибрилл, так и в виде шариков – глобул. Иногда глобулярные и фибриллярные формы встречаются в виде комплексов (в мышечной ткани комплекс актина с миозином; в плазме крови содержится фибрилл белка – фибриноген, а также глобулы белка – альбумины и глобулины).
1. Каталитическая – более 99% ферментов или биологических катализаторов являются белками; например каталаза, аспартат-аминотрансфераза. К 90-м годам 20 в. идентифицировано более 2000 ферментов белковой природы.
2. Питательная (или резервная) – казеин – белок молока, овальбумины – белки яйца.
3. Транспортная – дыхательная функция крови, в частности, перенос О2 осуществляется гемоглобином (Нв) - белком эритроцитов.
4. Защитная – специфические защитные белки-антитела нейтрализуют действие чужеродных белков-антигенов.
5. Сократительная – специфические белки мышечной ткани актин и миозин обеспечивают мышечные сокращения и расслабления, т.е. движение.
6. Структурная – такую функцию выполняют белки – коллаген соединительной ткани, кератин – в волосах, ногтях, коже.
7. Гормональная – регуляция обмена веществ осуществляется за счет гормонов – белков или полипептидов гипофиза, поджелудочной железы.
α-АК являются строительными блоками, из которых образуются белковые полипептидные цепи (ППЦ) и, собственно, сами белки. Аминокислоты – это производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на R.
Путем гидролиза из животных белков выделяют 19-25 α-АК, но обычно их получают 20. Общая формула аминокислот:
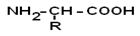
Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (>250 oС). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α-АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+ –группой.
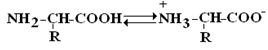
В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм.
В сильнокислой среде АК присутствуют в виде катионов (q +)
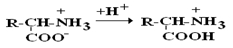
в сильнощелочной среде – в виде анионов (–q)
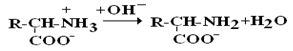
Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная концентрация «+» и «–» q аминокислот, а также белков, называется изоэлектрической точкой (pI). При достижении такой рН белок становится неподвижным в электрическом поле и выпадает в осадок, что используется в электрофоретических методах анализа белков и аминокислот.
Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структурехирального атома С. Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):
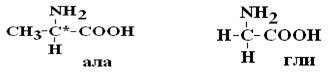
Оптически неактивной является только АК глицин, которая не имеет хирального центра.
Существуют два вида изомеров – структурные и стереоизомеры.
Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.

Стереоизомеры – это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.

Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами.
Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – левовращающим («–»). Природные аминокислоты являются как «+», так и «–».
Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью.
Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L–ряда. Для определения принадлежности АК к Д– или L–ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА).
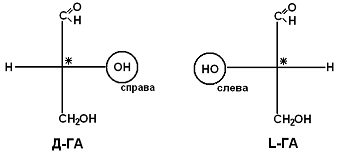
По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если слева – L–АК.

Все аминокислоты природных белков являются α–АК.
в соответствии с ней все аминокислоты делятся на 4 группы.
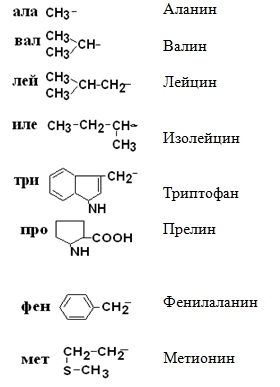
II –Полярные гидрофильные незаряженные аминокислоты – их 7.
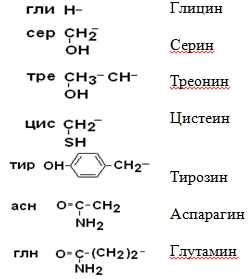
III – Отрицательно заряженные кислые аминокислоты
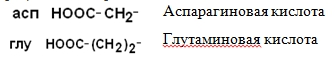
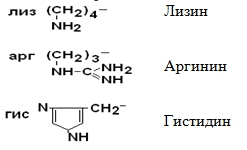
IV Положительно заряженные основные аминокислоты
α–СООН группа одной аминокислоты может реагировать с α–NH2 группой другой аминокислоты с образованием пептидных связей.
Пептидные цепи белков – это линейные полимеры α–АК, соединенных пептидной связью.
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым.
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие to и p, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана.
1. Титруются только концевые COOH– и NH2– группы.
2. При гидролизе белков образуется стехеометрическое количество титруемых COOH– и NH2–групп (происходит распад определенного числа пептидных связей).
3. Под действием протеолитических ферментов (протеаз) белки расщепляются на строго определенные фрагменты с концевыми аминокислотами, соответствующими избирательному действию протеаз.
4. Биуретовую реакцию (раствор сульфата меди CuSO4 в щелочной среде – сине-фиолетовое окрашивание) дают и биурет (NH2–CO–NH–CO–NH2), содержащий пептидную связь и белки.
5. Проведенный рентгеноструктурный анализ (разрешительная способность 0,15-0,2 нм) показывает на рентгенограмме пептидную связь.
6. Самое убедительное доказательство – это синтез химическими методами белков с уже расшифрованной структурой. Синтезированные белки обладают физико-химическими свойствами и биологической активностью, аналогичными природным белкам .

